到了二十世纪中叶,人们已经知道蛋白质是由氨基酸组成的,但不清楚如何将它们结合在一起的。它们是否以相似残基的形式排列?还是随机混合在一起?还是重复出现?有问题出现就会去思考对应的解决方法,大约在那个时候,人们设计出了一些方法为这些问题提供了答案:每个蛋白质的组成氨基酸残基以一种独特的顺序线性排列。
Pehr Edman于1950年公布了一种蛋白质测序方法——埃德曼降解法(Edman Degradation)。这种方法使得测定多肽或全蛋白的延伸序列成为可能,并被广泛应用到今天。该方法通过一系列的化学反应来去除和识别多肽链末端的氨基酸残基,即带有游离α-氨基的残基。同时,序列中的下一个残基被制造出来,并经受同样一轮化学反应。重复这一过程可以揭示多肽的序列。该方法为蛋白组学研究提供了工具。
埃德曼降解流程
主要分为耦合、切割、萃取、转化、鉴定等几个步骤。
1、耦合
异硫氰酸苯酯(PITC)在多肽链的N末端与a-氨基(或在脯氨酰残基带有亚氨基的情况下)反应,形成末端残基的苯硫代氨基甲酰基衍生物。该反应建议在pH=8.0的碱性环境下进行。通过上述描述可以看出,这个步骤需要游离的α-氨基。如果氨基已被修饰并且不再与PITC反应,则该多肽被称为“受阻”。例如,许多蛋白质被乙酰基、甲酰基或焦谷氨酰胺基阻断。在没有游离N末端的情况下,必须通过化学或酶促方法切割多肽以产生具有游离N末端的片段。在实际操作中,有必要避免样品被含有胺的非多肽物质污染,如trizma碱,因为这些物质也可能与PITC发生反应,产生干扰后续分析的产物。
2、环化裂解
在强酸存在下,在第一个肽键处发生裂解,使肽(减去第一个残基)和被释放的第一个残基形成苯胺噻唑啉酮(ATZ)形式。一旦其他反应物和产物被冲走,缩短的多肽可以通过另一轮的耦合和裂解来释放第二残留,如此循环往复。目前,三氟乙酸(TFA)被用于这种裂解反应。为了使多肽链内各点的酸水解较小化,尽可能保证是在无水条件下进行。以三氟乙酸(TFA)处理耦合后产物,将多肽或蛋白的N-端第一个肽键选择性的切断,释放出该氨基酸残基的噻唑啉酮苯胺衍生物。主要化学反应如下:用TFA处理PITC修饰的肽会导致分子内环化,其中PITC加合物的硫脲与第一个肽键的羰基成分反应。 这种环化作用释放出与第一个氨基酸缀合的PITC,形成一个新的N末端胺,同时保持ε-胺被封闭。
3、萃取、转化
通过有机溶剂(乙酸乙酯或氯丁烷)的萃取,将ATZ残基从肽中分离出来,在强酸性条件下转化成更稳定的苯硫基乙内酰脲(PTH)形式。一些修饰过的氨基酸残基(如糖基天冬酰胺)在有机溶剂中溶解性差,因此在序列中相应的位置出现空白。
4、PTH残基分析
由Edman化学反应的每个循环产生的PTH残基通常由色谱法识别,最初是薄层色谱法,后来是反相高效液相色谱法。通过与标准品比较,依次鉴定和定量衍生自每个循环的PTH氨基酸残基,并根据残基从N端到C端的顺序对序列进行描述。如果存在放射性氨基酸残基,则可以通过此阶段的活性来检测它们。
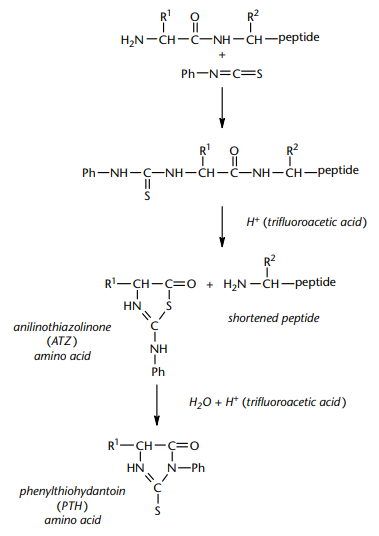
图1 利用埃德曼降解法进行多肽的N端测序
埃德曼降解法的局限性:
如果N末端经过化学修饰,则将无法使用
如果遇到非α-氨基酸,测序将停止
较大的蛋白质无法通过Edman测序进行测序
通常不能用于确定二硫键的位置
埃德曼降解法优势:
不需要样品预处理
识别确切的N末端氨基酸
通过色谱法鉴定和定量释放的氨基酸
使混合物中蛋白质的n端测序成为可能
参考文献:
Smith J B. Peptide sequencing by Edman degradation. e LS, 2001.
Bąchor R, Kluczyk A, Stefanowicz P, et al. New method of peptide cleavage based on Edman degradation. Molecular diversity, 2013, 17(3): 605-611.